RDC 302/2005 Anvisa: A norma que conduz os laboratórios clínicos

Os Laboratórios Clínicos brasileiros devem seguir uma legislação sanitária específica desde 2005. A RDC 302/2005 visa garantir a qualidade dos exames realizados por aproximadamente 18 mil laboratórios existentes no país. Dessa maneira, o controle interno da qualidade, com a nova legislação, passou a ser uma tarefa obrigatória dentro dos laboratórios, visando assegurar a qualidade dos resultados que vão auxiliar nos diagnósticos, prognósticos e tratamentos dos cidadãos.
Entregar um resultado seguro é, além de uma responsabilidade social, a comprovação de que o laboratório está atendendo as exigências da legislação vigente. É com base na RDC 302/2005 da Anvisa que os agentes sanitários municipais e estaduais aferem se os laboratórios clínicos possuem as condições consideradas mínimas para seu funcionamento e a prestação de serviços a que se propõem.
De acordo com o art. 4˚ do regulamento, o descumprimento das determinações previstas constitui infração de natureza sanitária. O infrator está sujeito a processo e penalidades previstas na lei.
A Norma dos Laboratórios Clínicos
 A RDC 302/2005 é um regulamento técnico amplo e de enfoque nas atividades diárias dos laboratórios clínicos. Ela aborda desde os passos para a coleta de material até a emissão dos laudos. Além disso, o regulamento trata ainda da Organização, Recursos Humanos, Infraestrutura e Biossegurança dos laboratórios.
A RDC 302/2005 é um regulamento técnico amplo e de enfoque nas atividades diárias dos laboratórios clínicos. Ela aborda desde os passos para a coleta de material até a emissão dos laudos. Além disso, o regulamento trata ainda da Organização, Recursos Humanos, Infraestrutura e Biossegurança dos laboratórios.
Para elaborar a RDC 302/2005 foi composto um grupo de trabalho que abrangeu secretarias de saúde, vigilâncias sanitárias, laboratórios, membros da Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial e Sociedade Brasileira de
Análises Clínicas, provedores de ensaio de proficiência
e um consultor técnico.
Durante 90 dias, a proposta foi disponibilizada para consulta pública e sugestões. A equipe da Biosoft (mantenedora do QualiChart) encaminhou sugestões e algumas foram agraciadas com a incorporação ao documento final. Dr. Silvio Basques, consultor científico do QualiChart, afirma que a consulta pública, de iniciativa da própria Anvisa, foi importante fator para o aperfeiçoamento do regulamento.
O documento normatiza as atividades laboratoriais nas áreas de análises clínicas, patologia clínica e citologia.
O Controle Interno da Qualidade e a RDC 302/2005
O principal foco da RDC 302/2005 é a garantia da qualidade. Tem por definição ser um “conjunto de atividades planejadas, sistematizadas e implantadas com o objetivo de cumprir os requisitos da qualidade especificados”. Uma das atividades que compõe a garantia da qualidade é o controle interno.
A partir da nova regulamentação tornou-se obrigatório que os laboratórios clínicos realizem diariamente o controle interno da qualidade. De acordo com o documento, o laboratório clínico deve assegurar a confiabilidade dos serviços laboratoriais prestados, por meio de, no mínimo: controle interno da qualidade e controle externo da qualidade.
9.2.1 O LABORATÓRIO CLÍNICO DEVE REALIZAR CONTROLE INTERNO DA QUALIDADE CONTEMPLANDO:
A) MONITORAMENTO DO PROCESSO ANALÍTICO PELA ANÁLISE DAS AMOSTRAS CONTROLE, COM REGISTRO DOS RESULTADOS OBTIDOS E ANÁLISE DOS DADOS;
B) DEFINIÇÃO DOS CRITÉRIOS DE ACEITAÇÃO DOS RESULTADOS POR TIPO DE ANALITO E DE ACORDO COM A METODOLOGIA UTILIZADA;
C) LIBERAÇÃO OU REJEIÇÃO DAS ANÁLISES APÓS AVALIAÇÃO DOS RESULTADOS DAS AMOSTRAS CONTROLE.
9.2.2 PARA O CIQ, O LABORATÓRIO CLÍNICO DEVE UTILIZAR AMOSTRAS CONTROLE COMERCIAIS, REGULARIZADOS JUNTO A ANVISA/MS DE ACORDO COM A LEGISLAÇÃO VIGENTE.
9.2.2.1 FORMAS ALTERNATIVAS DESCRITAS NA LITERATURA PODEM SER UTILIZADAS DESDE QUE PERMITAM A AVALIAÇÃO DA PRECISÃO DO SISTEMA ANALÍTICO.
9.2.3 O LABORATÓRIO CLÍNICO DEVE REGISTRAR AS AÇÕES ADOTADAS DECORRENTES DE REJEIÇÕES DE RESULTADOS DE AMOSTRAS CONTROLE.
9.2.4 AS AMOSTRAS CONTROLE DEVEM SER ANALISADAS DA MESMA FORMA QUE AMOSTRAS DOS PACIENTES.
Acreditação e a Resolução Normativa
A Resolução Normativa n˚ 267 estabeleceu que os laboratórios clínicos devem participar de um programa de acreditação e ainda identificar qual entidade acreditadora escolheu. O artigo 7˚ da resolução destaca como obrigatória a divulgação da qualificação do laboratório em seus materiais institucionais. O Brasil possui diversos órgãos acreditadores. Os mais adequados para os laboratórios são:
- PALC: Programa de Acreditação de Laboratórios Clínicos. Pertence a Sociedade Brasileira de Patologia Clínica/ Medicina Laboratorial (SBPC/ML);
- DICQ: Departamento de Inspeção e Controle Interno da Qualidade. Pertence a Sociedade Brasileira de Análises Clínicas (SBAC).
Até a data presente, nós encontramos 243 laboratórios acreditados pelos dois órgãos. Desse grupo, é de se notar que mais da metade utilizam o sistema de Controle Interno da Qualidade do QualiChart.
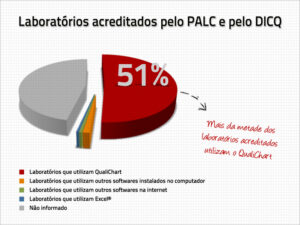
O controle interno da qualidade é requisito obrigatório tanto para os órgãos acreditadores, quanto para a RDC 302/2005. Com o QualiChart, além de ter todo o processo de controle interno automatizado, você recebe alertas de não-conformidades e relatórios que evidenciam a sua estrutura do controle interno da qualidade quantitativo.
Esses relatórios são fundamentais no processo de acreditação, além de auxiliar nas melhorias contínuas da sua gestão da qualidade.
Rotulagem no Laboratório Clínico: Exigência pra melhoria da qualidade
A rotulagem de equipamentos, aparelhos, frascos, reagentes, gavetas e até mesmo documentos é um exemplo disso. Apesar de ser uma exigência da Anvisa, dos órgãos de acreditação e das normas de biossegurança, muitos laboratórios deixam essa tarefa em segundo plano.
A RDC 302/2005 estabelece em seus requisitos obrigatórios que todo laboratório deve rotular reagentes e insumos preparados no local.
5.5.3 O REAGENTE OU INSUMO PREPARADO OU ALIQUOTADO PELO PRÓPRIO LABORATÓRIO DEVE SER IDENTIFICADO COM RÓTULO CONTENDO: NOME, CONCENTRAÇÃO, NÚMERO DO LOTE (SE APLICÁVEL), DATA DE PREPARAÇÃO, IDENTIFICAÇÃO DE QUEM PREPAROU (QUANDO APLICÁVEL), DATA DE VALIDADE, CONDIÇÕES DE ARMAZENAMENTO, ALÉM DE INFORMAÇÕES REFERENTES A RISCOS POTENCIAIS.
A rotulagem de equipamentos pode muitas vezes passar despercebida pelos profissionais e donos de laboratório. Porém, esta é uma tarefa que auxilia no trabalho, no dia a dia e na qualidade dos resultados entregues aos pacientes.
A identificação é importante até mesmo para a segurança dos funcionários. A exposição diária a materiais que podem estar contaminados é a principal causa de acidentes dentro do laboratório clínico. Por isso, a necessidade de sinalizar adequadamente os locais e materiais de risco, no caso, risco biológico.
A Associação Brasileira de Normas Técnicas – ABNT regulamentou em 2001 a NBR 14.785 que trata dos Requisitos de Segurança nos Laboratórios Clínicos. Segundo a norma “as áreas de risco devem ser identificadas de acordo com a legislação vigente, de maneira clara e o pessoal deve ser treinado e possuir instruções específicas, incluindo os procedimentos de emergência”.
Esta norma foi criada pela ABNT como forma de proteção individual para quem trabalha em laboratórios clínicos e também para seus pacientes. Seu objetivo é estabelecer especificações de segurança que possam ser aplicáveis aos laboratórios clínicos preservando a integridade de todos os envolvidos.
Todo material que for entregue ao paciente, se apresentar algum potencial de risco, como, por exemplo, frasco com conservante para coleta especial, deve estar devidamente identificado.
Requisitos de Segurança para laboratórios clínicos
De acordo com a RDC 302/2005, é importante que os laboratórios clínicos criem um manual de biossegurança para treinar e capacitar sua equipe. Em muitos laboratórios são utilizados os Procedimentos Operacionais Padrão (POP) que visam a padronizar condutas e minimizar a ocorrência de erros no dia a dia.
A Anvisa define biossegurança como “condições de segurança alcançada por um conjunto de ações destinadas a prevenir, controlar, reduzir ou eliminar riscos inerentes às atividades que possam comprometer a saúde humana, animal e o meio ambiente”.
A RDC 302/2005 solicita ainda que as instruções de biossegurança sejam disponibilizadas aos funcionários de forma escrita, contendo os seguintes pontos:
a) normas e condutas de segurança biológica, química, física, ocupacional e ambiental;
b) instruções de uso para os equipamentos de proteção individual (EPI) e de proteção coletiva (EPC);
c) procedimentos em caso de acidentes;
d) manuseio e transporte de material e amostra biológica.
Para saber mais sobre a importância da realização do Controle Interno da Qualidade, baixe gratuitamente o ebook: 6 Razões para Cuidar do Controle Interno da Qualidade.
ebook
6 razões para cuidar do Controle Interno da Qualidade no laboratório clínico
Encontre as razões de se fazer o controle da Qualidade e os benefícios alcançados!

